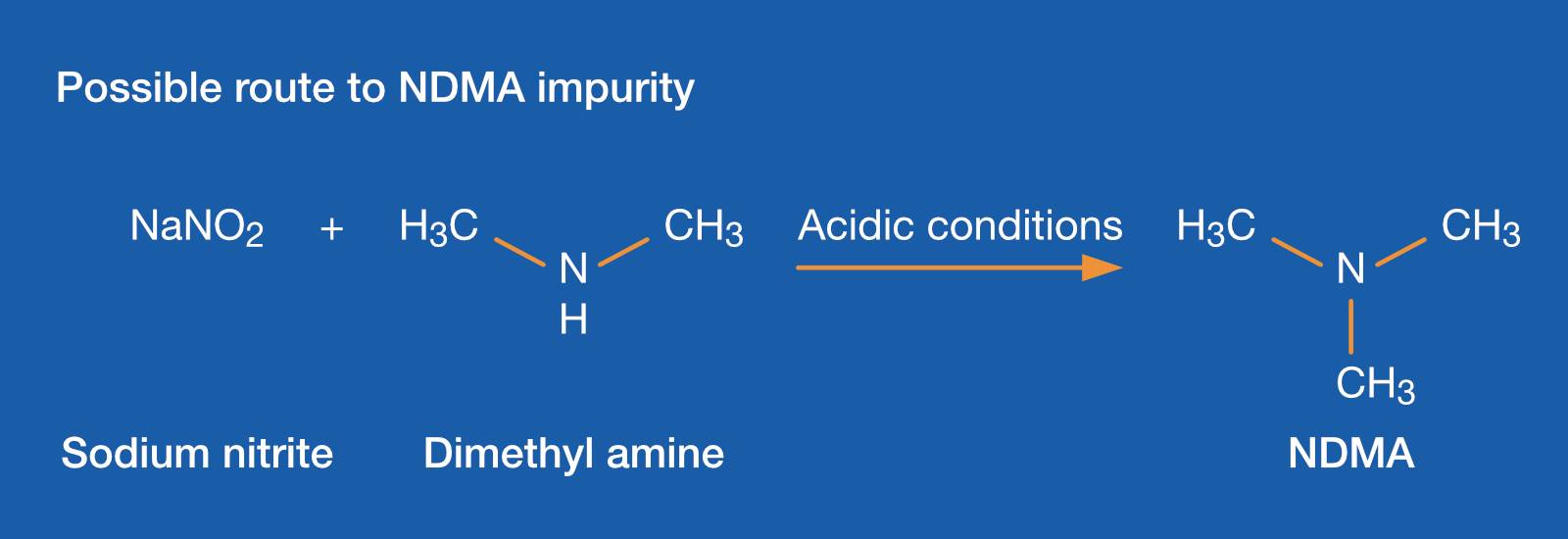
entoxische Verunreinigungen, wie Nitrosamine und ihre Vorstufen, sind ein großes Problem für bestimmte Arzneimittel. Die US Food and Drug Administration (USFDA) und die European Medical Agency (EMA) verlangen die Messung ihrer Konzentration in chemisch synthetisierten APIs.
Es gibt viele mögliche Quellen für diese Verunreinigungen. Dazu gehören Rohmaterialien, Verarbeitung, Verpackung, Umwelt und Ausrüstung, um nur einige zu nennen.
Es gibt erhebliche Diskussionen darüber, was die zulässigen Grenzwerte für diese Verbindungen sind und wie der Grenzwert abgeleitet werden sollte.
Im EMS-Bewertungsbericht EMA/369136/2020 vom 25. Juni 2020 heißt es:
| Für bestimmte N-Nitrosamine wurden die folgenden Grenzwerte emittelt, die angewendet werden sollten: N-Nitrosamine (CAS Nummer) | ng/Tag*** |
|---|---|
| NDMA* (62-75-9) | 96.0 |
| NDEA*(55-18-5) | 26.5 |
| EIPNA**(16339-04-1) | 26.5 |
| DIPNA**(601-77-4) | 26.5 |
| NMBA**(61445-55-4) | 96.0 |
| MeNP**(16339-07-4) | 26.5 |
| NDBA**(924-16-3) | 26.5 |
Diese Grenzwerte gelten nur, wenn ein Fertigprodukt ein einzelnes N-Nitrosamin enthält.
*Grenzwert berechnet auf der Grundlage des harmonischen Mittelwerts TD50, abgeleitet aus der Datenbank für krebserzeugende Wirkstoffe (CPDB).
**Grenzwert abgeleitet unter Verwendung des SAR/read-across-Ansatzes
***Die Umrechnung in einen Spezifikationsgrenzwert in ppm für ein bestimmtes Arzneimittel wird berechnet, indem der jeweilige oben genannte Grenzwert (ng) durch die maximale Tagesdosis (mg) eines bestimmten Produkts, wie in der Fachinformation (SmPC) angegeben, dividiert wird.
 CHINESE / 中文语言
CHINESE / 中文语言  FRENCH / FRANCAIS
FRENCH / FRANCAIS  ENGLISH / ANGLAIS
ENGLISH / ANGLAIS  KOREAN / 한국어
KOREAN / 한국어  POLISH / JEZYK POLSKI
POLISH / JEZYK POLSKI  JAPANESE / NIHONGO
JAPANESE / NIHONGO  TURKISH / TÜRK DILI
TURKISH / TÜRK DILI  SPANISH / ESPAÑOL
SPANISH / ESPAÑOL  ITALIAN Italiano
ITALIAN Italiano